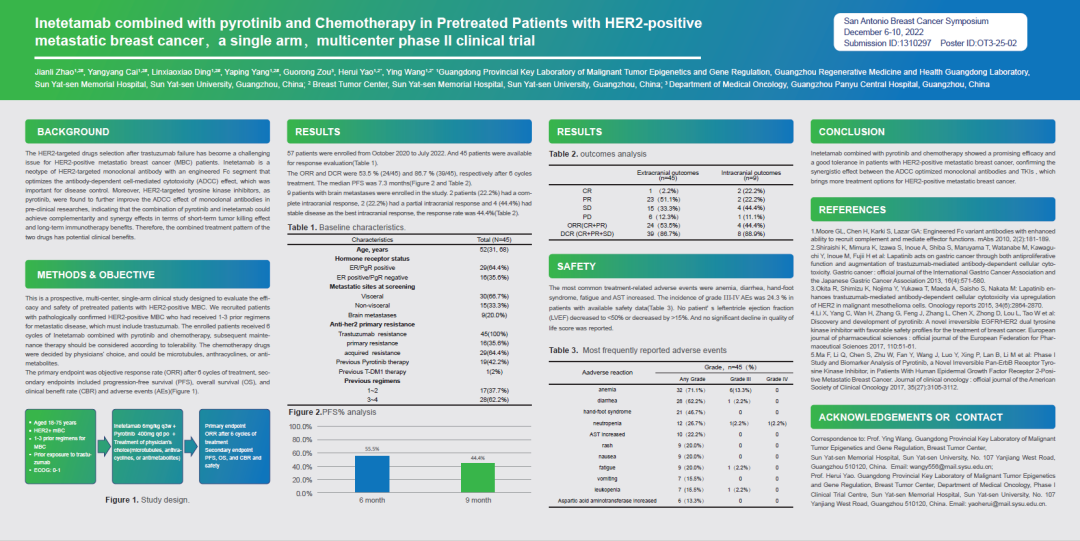
2022 年 12 月 6 日,圣安东尼奥乳腺癌大会(SABCS)正式拉开序幕。一项赛普汀®(伊尼妥单抗)联合吡咯替尼和化疗治疗 HER2 阳性转移性乳腺癌患者的单臂多中心 II 期临床试验研究进展结果在本次大会的壁报中公开。该项研究由中国抗癌协会“HER2 靶点中国科学研究基金”资助,中山大学孙逸仙纪念医院姚和瑞教授、汪颖教授、赵健丽教授牵头。初步研究结果显示:伊尼妥单抗联合吡咯替尼及化疗药物在经曲妥珠单抗药物治疗失败的 HER2 阳性转移性乳腺癌患者 ORR 及 DCR 分别为 53.5%和 86.7%,中位 PFS 为 7.3 个月;入组的9例脑转移患者,颅内缓解应答率为 44.4%,疾病控制率 88.9%;研究中患者耐受性良好、安全性可控。




San Antonio Breast Cancer Symposium
December 6-10, 2022
Submission ID:1310297 Poster ID:OT3-25-02
Inetetamab combined with pyrotinib and Chemotherapy in Pretreated Patients with HER2-positive metastatic breast cancer,a single arm,multicenter phase II clinical trial
研究者:姚和瑞 汪颖 赵健丽
HER2 阳性乳腺癌约占所有乳腺癌的15%~20%,其侵袭性强且预后较差。曲妥珠单抗是第一个 HER2 靶向药物,显著改善了 HER2 阳性乳腺癌患者的预后,但仍有相当一部分患者会出现曲妥珠单抗耐药,因此,曲妥珠单抗治疗失败后的后线治疗方案选择成为新的困难与挑战。

对于使用曲妥珠单抗药物治疗失败的 HER2 阳性转移性乳腺癌患者来说,选择何种合适的 HER2 靶向药成为一个具有挑战性的问题。伊尼妥单抗是由三生国健自主研发的创新抗 HER2 单抗,2020年 6 月正式获得国家药品监督管理局(NMPA)批准,可联合化疗用于治疗 HER2 阳性的转移性乳腺癌。伊尼妥单抗通过对 Fc 段进行氨基酸修饰,显著提升了 Fc 段受体亲和力,进而增强了抗体依赖的细胞介导的细胞毒性作用(ADCC),对肿瘤疾病控制具有重要作用。酪氨酸蛋白激酶抑制剂(TKI:如吡咯替尼),是近年来抗 HER2 治疗领域出色的 TKI,其可通过增强抗 HER2 单抗的 ADCC 作用和增强 HER2 表达强化抗 HER2 单抗的疗效。就短期肿瘤杀伤效果和长期免疫治疗益处来说,伊尼妥单抗与吡咯替尼或在机制上也具有良好的潜在协同效应。因此,这两种药物的联合治疗有望获得更好地潜在临床价值。本研究旨在研究伊尼妥单抗联合酪氨酸蛋白激酶抑制剂药物及化疗药物对曲妥珠单抗治疗失败的 HER2 阳性转移性乳腺癌患者的有效性及安全性。

该研究是一项前瞻性、多中心、单臂临床研究,在既往经曲妥珠单抗治疗失败HER2阳性转移性乳腺癌患者,接受6周期伊尼妥单抗联合吡咯替尼及化疗药物治疗,其中化疗药物由医师根据患者情况选择,可包括微管抑制剂、蒽环类、抗代谢类药。在此研究中,患者静脉注射伊尼妥单抗(6mg/kg,每三周一次),口服吡咯替尼(400mg,一天一次)及化疗药(卡培他滨、长春瑞滨、吉西他滨或艾立布林等)。研究主要终点为6周期后客观缓解率(ORR),次要研究终点包括无进展生存期(PFS)、总生存期(OS)、临床获益率(CBR)以及不良反应事件(AEs)。

2020年10月至2022年7月共计纳入57例患者,45例可评估患者(表1)经过6周期分别治疗后,其ORR及DCR分别为53.5%(24/45)和86.7%(39/45),中位PFS为7.3个月(图1)。研究纳入9例基线时合并脑转移的患者,2例(22.2%)颅内病灶完全缓解,2例(22.2%)颅内病灶部分缓解,4例(44.4%)颅内病灶稳定。
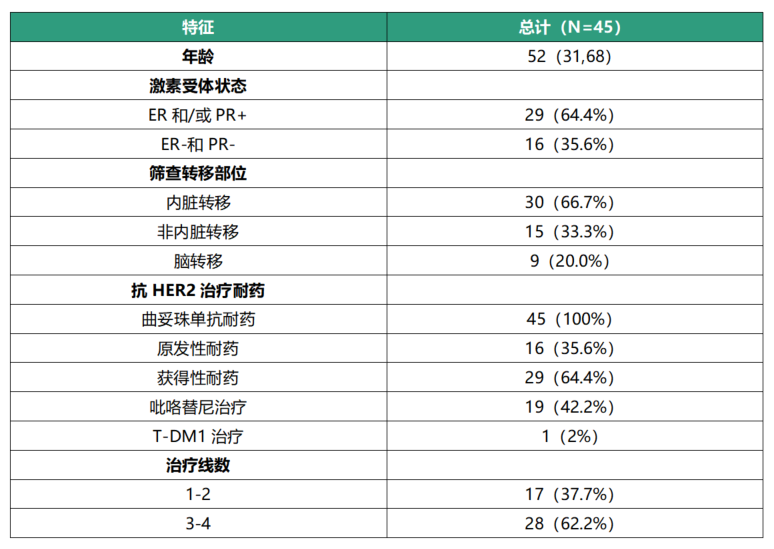
表1 基线特征
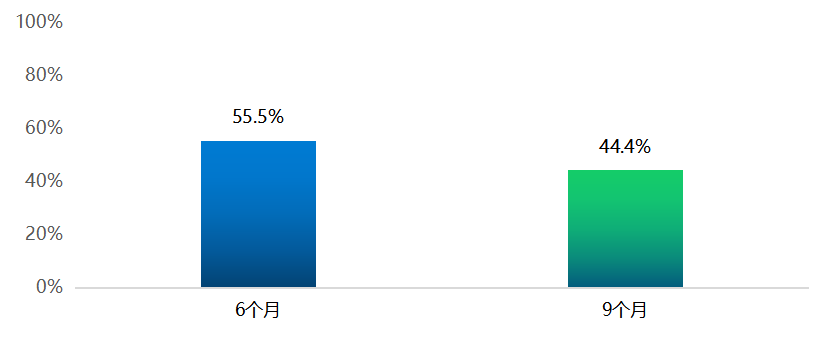
图1 PFS率
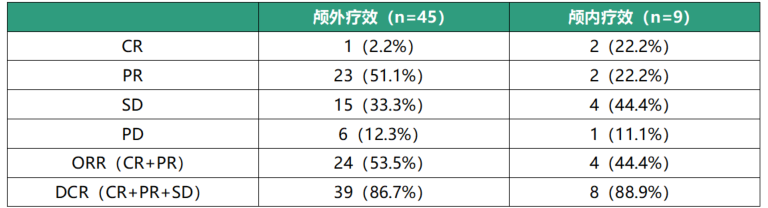
表2 结果分析
在本研究中最常见的不良反应为贫血、腹泻、手足综合征、疲劳和AST升高。在有安全性数据的患者中,Ⅲ-Ⅳ级不良反应发生率为24.3%(表3),没有患者的左心室射血分数(LVEF)下降到<50%或下降>15%,患者生活质量评分无明显下降。
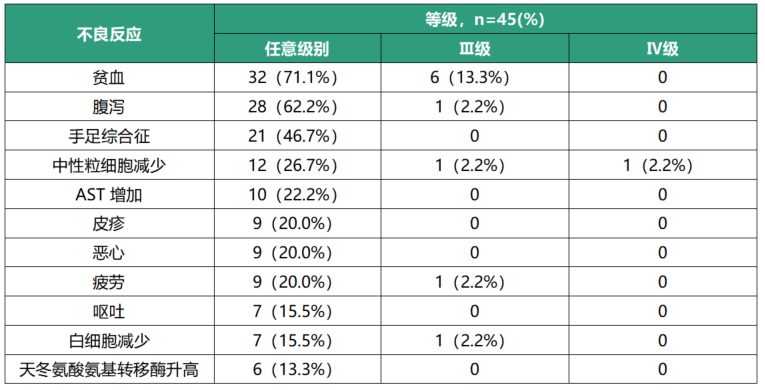
表3 常见不良反应

伊尼妥单抗联合吡咯替尼及化疗在HER2阳性转移性乳腺癌患者中展现出了良好的疗效及耐受性,安全性可控。证实了优化的ADCC 效应与TKI药物间存在增效协同抗肿瘤作用,为HER2阳性转移性乳腺癌患者提供更多治疗选择。
中国抗癌协会“HER2 靶点中国科学研究基金”资助课题,项目编号:CORP-239-S10

赛普汀®(伊尼妥单抗)是中国第一个获批上市的 Fc 段修饰,生产工艺优化,具有更强 ADCC 效应的创新抗 HER2 单抗,与化疗药物联合,已被证明可以延缓 HER2 阳性的转移性乳腺癌患者病情进展,并带来生存获益。作为国家“十二五”生物制药重大专项项目,伊尼妥单抗于 2020 年 6 月获得 NMPA 批准上市,其上市打破了外资药企长达 18 年的抗HER2 单抗垄断地位,有力地推进了中国抗体生物药的自主研发热潮。2020 年 12 月底,伊尼妥单抗通过了医保谈判,首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2020 年版)》。目前,伊尼妥单抗被正式纳入 CSCO 乳腺癌诊疗指南和 CACA-CBCS 指南等国内权威指南,成为晚期乳腺癌全程抗 HER2 治疗的基础药物,在 2022 版CSCO 乳腺癌诊疗指南中被列为 HER2+晚期乳腺癌 H 敏感患者抗 HER2 治疗的 I 级推荐用药。
参考文献
[1]Jianli Zhao. Inetetamab combined with pyrotinib and Chemotherapy in Pretreated Patients with HER2-positive metastatic breast cancer,a single arm,multicenter phase II clinical trial[N].San Antonio Breast Cancer Symposium.2022.
关于三生国健
三生国健成立于2002年,是中国第一批专注于抗体药物的创新型生物医药企业,已发展为同时具备自主研发、产业化及商业化能力的中国抗体药物先行者。公司以创新型治疗性抗体药物为主要研发方向,为自身免疫性疾病等重大疾病治疗领域提供高品质、安全有效的临床解决方案。目前,公司拥有16个处于不同开发阶段,其中大部分在研药物为治疗用生物制品1类,部分在研药物为中美双报。请访问www.3s-guojian.com获取更多信息。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。