近日,三生国健自主研发的创新型抗HER2单抗——赛普汀®(伊尼妥单抗)成功纳入国家卫健委《新型抗肿瘤药物临床应用指导原则(2021年版)》(以下简称:《指导原则》)。
自2018年首版发布后,《指导原则》每年进行更新,目前已成为国内可及、各专科、各种新型抗癌药物规范化使用的“标杆文件”。《指导原则》指出,抗肿瘤药物临床应用需考虑药物可及性、患者治疗意愿和疾病预后三大要素。抗肿瘤药物临床应用是否合理,基于以下两方面:有无抗肿瘤药物应用指征、选用的品种及给药方案是否适宜。
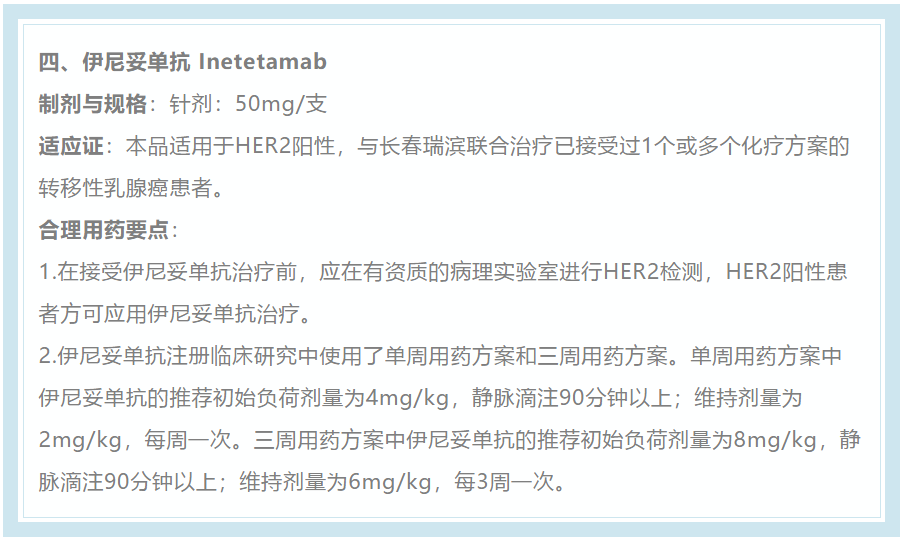
在2020年及2021年的《指导原则》中,伊尼妥单抗的单周用药方案和三周用药方案均被认可为晚期HER2阳性乳腺癌患者常规可用方案。
2020年全球新发癌症病例1929万例,其中乳腺癌新发病例高达226万例,成为全球第一大癌。2020年中国癌症新发病例数前十中乳腺癌位列第四,高达42万。从历年全国癌症统计数据报告来看,近年来乳腺癌发病率不断攀升,目前已成为女性发病率最高的癌种,其中 HER2阳性乳腺癌占比达到20%-25%。
过去,HER2基因扩增或高表达患者预后往往较差,伴随着国内外抗HER2靶向治疗药物的不断创新升级,患者生存得到极大改善。即便如此,HER2 阳性乳腺癌治疗仍存在未满足需求。
作为临床迫切需求的抗肿瘤药物,伊尼妥单抗的上市为临床提供了新的药物选择,此后迅速被纳入新版国家医保药品目录,进一步提升了HER2阳性乳腺癌患者的用药可及性。期盼在纳入《指导原则》后,能够为更多HER2阳性乳腺癌患者带来生存获益。
关于赛普汀®
赛普汀®(伊尼妥单抗)是中国第一个获批上市的 Fc 段修饰,生产工艺优化,具有更强 ADCC 效应的创新抗 HER2 单抗,与化疗药物联合,已被证明可以延缓 HER2 阳性的转移性乳腺癌患者病情进展,并带来生存获益。作为国家“十二五”生物制药重大专项项目,赛普汀®于 2020 年 6 月获得 NMPA 批准上市,其上市打破了外资药企长达18年的抗HER2单抗垄断地位,有力地推进了中国抗体生物药的自主研发热潮。2020 年12 月底,赛普汀®通过了医保谈判,首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2020年版)》,于2021年3月1日执行。2021年,赛普汀®被正式纳入CSCO乳腺癌诊疗指南和CACA-CBCS指南,成为晚期乳腺癌全程抗HER2治疗的基础药物。
关于三生国健
三生国健成立于2002年,是中国第一批专注于抗体药物的创新型生物医药企业,已发展为同时具备自主研发、产业化及商业化能力的中国抗体药物先行者。公司以创新型治疗性抗体药物为主要研发方向,为自身免疫性疾病、肿瘤等重大疾病治疗领域提供高品质、安全有效的临床解决方案。目前,公司拥有近20个处于不同开发阶段、涵盖自身免疫、肿瘤及眼科等疾病领域的在研抗体药物,其中大部分在研药物为治疗用生物制品1类,部分在研药物为中美双报。请访问www.3s-guojian.com获取更多信息。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。
自2018年首版发布后,《指导原则》每年进行更新,目前已成为国内可及、各专科、各种新型抗癌药物规范化使用的“标杆文件”。《指导原则》指出,抗肿瘤药物临床应用需考虑药物可及性、患者治疗意愿和疾病预后三大要素。抗肿瘤药物临床应用是否合理,基于以下两方面:有无抗肿瘤药物应用指征、选用的品种及给药方案是否适宜。

在2020年及2021年的《指导原则》中,伊尼妥单抗的单周用药方案和三周用药方案均被认可为晚期HER2阳性乳腺癌患者常规可用方案。

2020年全球新发癌症病例1929万例,其中乳腺癌新发病例高达226万例,成为全球第一大癌。2020年中国癌症新发病例数前十中乳腺癌位列第四,高达42万。从历年全国癌症统计数据报告来看,近年来乳腺癌发病率不断攀升,目前已成为女性发病率最高的癌种,其中 HER2阳性乳腺癌占比达到20%-25%。
过去,HER2基因扩增或高表达患者预后往往较差,伴随着国内外抗HER2靶向治疗药物的不断创新升级,患者生存得到极大改善。即便如此,HER2 阳性乳腺癌治疗仍存在未满足需求。
作为临床迫切需求的抗肿瘤药物,伊尼妥单抗的上市为临床提供了新的药物选择,此后迅速被纳入新版国家医保药品目录,进一步提升了HER2阳性乳腺癌患者的用药可及性。期盼在纳入《指导原则》后,能够为更多HER2阳性乳腺癌患者带来生存获益。
关于赛普汀®
赛普汀®(伊尼妥单抗)是中国第一个获批上市的 Fc 段修饰,生产工艺优化,具有更强 ADCC 效应的创新抗 HER2 单抗,与化疗药物联合,已被证明可以延缓 HER2 阳性的转移性乳腺癌患者病情进展,并带来生存获益。作为国家“十二五”生物制药重大专项项目,赛普汀®于 2020 年 6 月获得 NMPA 批准上市,其上市打破了外资药企长达18年的抗HER2单抗垄断地位,有力地推进了中国抗体生物药的自主研发热潮。2020 年12 月底,赛普汀®通过了医保谈判,首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2020年版)》,于2021年3月1日执行。2021年,赛普汀®被正式纳入CSCO乳腺癌诊疗指南和CACA-CBCS指南,成为晚期乳腺癌全程抗HER2治疗的基础药物。
关于三生国健
三生国健成立于2002年,是中国第一批专注于抗体药物的创新型生物医药企业,已发展为同时具备自主研发、产业化及商业化能力的中国抗体药物先行者。公司以创新型治疗性抗体药物为主要研发方向,为自身免疫性疾病、肿瘤等重大疾病治疗领域提供高品质、安全有效的临床解决方案。目前,公司拥有近20个处于不同开发阶段、涵盖自身免疫、肿瘤及眼科等疾病领域的在研抗体药物,其中大部分在研药物为治疗用生物制品1类,部分在研药物为中美双报。请访问www.3s-guojian.com获取更多信息。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。