2023年美国临床肿瘤学会(ASCO)年会将于2023年6月2日至6日在美国伊利诺伊州芝加哥以线上线下混合会议形式举行。5月26日,ASCO公布了此次年会部分入选研究的摘要内容,伊尼妥单抗(赛普汀®)有多项临床研究入选!其中一项由中山大学肿瘤防治中心方文峰教授团队开展的针对HER2基因突变的非小细胞肺癌(NSCLC)的Ib期研究(NCT 05016544)初步分析结果表明:伊尼妥单抗(赛普汀®)联合吡咯替尼治疗HER2基因突变的NSCLC患者耐受性良好,其中320mg组疗效更佳。
研究题目:伊尼妥单抗联合吡咯替尼治疗HER2突变型非小细胞肺癌(NSCLC)的安全性和疗效研究:一项开放标签的Ib期研究
研究背景:
目前,HER2突变型NSCLC患者的靶向治疗研究证据有限。此前研究表明,吡咯替尼对HER2突变的晚期NSCLC患者具有抗肿瘤活性。伊尼妥单抗是一种重组的人源化抗HER2单克隆抗体,与曲妥珠单抗具有相同的Fab段,Fc段2个氨基酸位点进行修饰。伊尼妥单抗联合吡咯替尼是否能显示出可控的安全性和有效的抗肿瘤活性尚不清楚。故研究旨在评估伊尼妥单抗联合吡咯替尼治疗晚期非小细胞肺癌HER2突变患者的安全性和有效性。
研究方法:
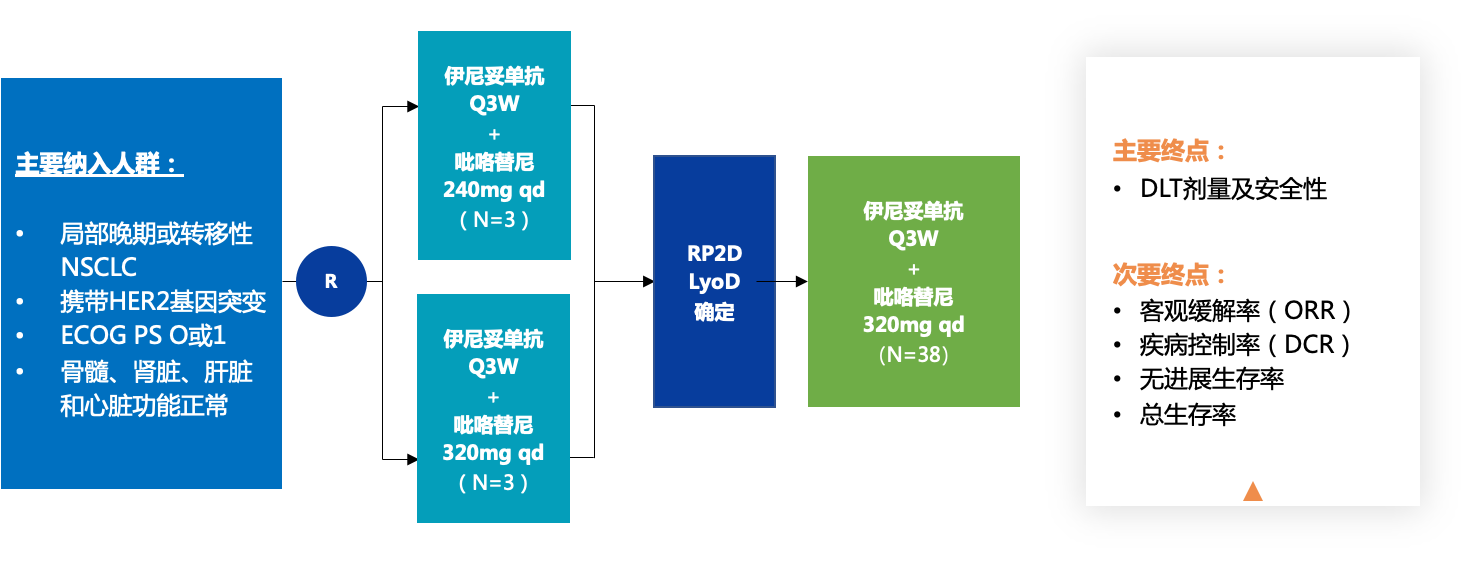
该研究是一项开放标签的Ib期研究。携带HER2基因突变的局部晚期或转移性NSCLC患者接受伊尼妥单抗联合吡咯替尼方案治疗。该研究由剂量递增部分和剂量扩展部分组成。在剂量递增期间,采用平行的“3+3”剂量递增设计来确定剂量限制毒性(DLT)。伊尼妥单抗采用3周给药方案(第1周期为8 mg/kg负荷剂量,后续各周期为6 mg/kg),同时予吡咯替尼(剂量递增部分,240 mg qd,320 mg qd;剂量扩大部分,320 mg qd)。研究的主要终点是DLT的剂量和安全性。在第一次给药后的21天内评估DLT。次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、无进展生存率和总生存率。
研究结果:
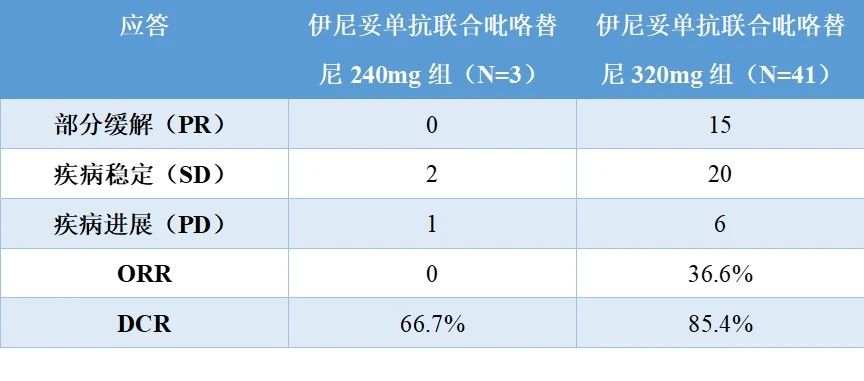
2021年8月6日至2022年8月25日,共纳入44例患者,其中3例为伊尼妥单抗联合240mg吡咯替尼组,41例为伊尼妥单抗联合320mg吡咯替尼组。吡咯替尼240mg和320mg递增期未发生DLT。因此,选择吡咯替尼320mg作为扩张剂量研究。最常见的治疗相关不良事件(TRAE)是腹泻(240 mg组为66.7%[2/3],320 mg组为95.6%[43/45])、皮疹(240 mg的66.7%[2/3]、320 mg的22.2%[10/45])和呕吐(240 mg为0,320 mg的24.4%[11/45])。TRAEs一般为1-2级。只有7名患者报告了3级TRAEs(240 mg吡替尼组1例,320 mg吡替替尼组6例)。初步疗效如下表所示。伊尼妥单抗联合吡咯替尼240mg组的ORR和DCR分别为0%和66.7%。伊尼妥单抗联合吡咯替尼320mg组的ORR和DCR分别为36.6%和85.4%,中位PFS为5.5个月(95%CI,4.4-8.6个月)。
研究结论:
伊尼妥单抗联合吡咯替尼的初步数据显示,在携带HER2突变的晚期NSCLC患者中,具有可观的抗肿瘤活性。同时不良反应较少,安全可控。

参考文献:
Wenfeng Fang, Yuanyuan Zhao, Yan Huang, et al. Safety and efficacy of inetetamab in combination with pyrotinib in HER2 mutant patients with non-small cell lung cancer (NSCLC): An open-label, phase Ib trial. J Clin Oncol 41, 2023 (suppl 16; abstr 9105)
关于赛普汀®:
赛普汀®(伊尼妥单抗)是中国首个获批上市的创新抗 HER2 单抗,与化疗药物联合,可用于治疗HER2 阳性的转移性乳腺癌患者。作为国家“十二五”生物制药重大专项项目,伊尼妥单抗于 2020 年 6 月获得 NMPA 批准上市,其上市打破了外资药企长达 18 年的抗HER2 单抗垄断地位,有力地推进了中国抗体生物药的自主研发热潮。2020 年 12 月底,伊尼妥单抗通过了医保谈判,首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2020 年版)》。目前,伊尼妥单抗被正式纳入 CSCO 乳腺癌诊疗指南和 CACA-CBCS 指南等国内权威指南,成为晚期乳腺癌全程抗 HER2 治疗的基础药物,在 2023 版CSCO 乳腺癌诊疗指南中被列为 HER2+晚期乳腺癌 H 敏感患者抗 HER2 治疗的 I 级推荐用药。
关于三生国健
三生国健是中国首批专注于创新型抗体药物研究并持续积极创新,拥有研、产、销一体化成熟平台,专注于单抗、双抗、多抗及多功能重组蛋白等新技术研究。公司拥有超过18年大规模抗体产业化和质量控制经验,并多维度布局CDMO业务,巩固和增强创新型治疗药物企业的领导地位。目前,公司拥有13个处于不同开发阶段的在研创新药物,其中大部分在研药物为治疗用生物制品1类,部分在研药物为中美双报。请访问www.3s-guojian.com获取更多信息。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。

摘要号:9105
研究题目:伊尼妥单抗联合吡咯替尼治疗HER2突变型非小细胞肺癌(NSCLC)的安全性和疗效研究:一项开放标签的Ib期研究
研究背景:
目前,HER2突变型NSCLC患者的靶向治疗研究证据有限。此前研究表明,吡咯替尼对HER2突变的晚期NSCLC患者具有抗肿瘤活性。伊尼妥单抗是一种重组的人源化抗HER2单克隆抗体,与曲妥珠单抗具有相同的Fab段,Fc段2个氨基酸位点进行修饰。伊尼妥单抗联合吡咯替尼是否能显示出可控的安全性和有效的抗肿瘤活性尚不清楚。故研究旨在评估伊尼妥单抗联合吡咯替尼治疗晚期非小细胞肺癌HER2突变患者的安全性和有效性。
研究方法:
该研究是一项开放标签的Ib期研究。携带HER2基因突变的局部晚期或转移性NSCLC患者接受伊尼妥单抗联合吡咯替尼方案治疗。该研究由剂量递增部分和剂量扩展部分组成。在剂量递增期间,采用平行的“3+3”剂量递增设计来确定剂量限制毒性(DLT)。伊尼妥单抗采用3周给药方案(第1周期为8 mg/kg负荷剂量,后续各周期为6 mg/kg),同时予吡咯替尼(剂量递增部分,240 mg qd,320 mg qd;剂量扩大部分,320 mg qd)。研究的主要终点是DLT的剂量和安全性。在第一次给药后的21天内评估DLT。次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、无进展生存率和总生存率。

研究设计
研究结果:
2021年8月6日至2022年8月25日,共纳入44例患者,其中3例为伊尼妥单抗联合240mg吡咯替尼组,41例为伊尼妥单抗联合320mg吡咯替尼组。吡咯替尼240mg和320mg递增期未发生DLT。因此,选择吡咯替尼320mg作为扩张剂量研究。最常见的治疗相关不良事件(TRAE)是腹泻(240 mg组为66.7%[2/3],320 mg组为95.6%[43/45])、皮疹(240 mg的66.7%[2/3]、320 mg的22.2%[10/45])和呕吐(240 mg为0,320 mg的24.4%[11/45])。TRAEs一般为1-2级。只有7名患者报告了3级TRAEs(240 mg吡替尼组1例,320 mg吡替替尼组6例)。初步疗效如下表所示。伊尼妥单抗联合吡咯替尼240mg组的ORR和DCR分别为0%和66.7%。伊尼妥单抗联合吡咯替尼320mg组的ORR和DCR分别为36.6%和85.4%,中位PFS为5.5个月(95%CI,4.4-8.6个月)。

研究结论:
伊尼妥单抗联合吡咯替尼的初步数据显示,在携带HER2突变的晚期NSCLC患者中,具有可观的抗肿瘤活性。同时不良反应较少,安全可控。
参考文献:
Wenfeng Fang, Yuanyuan Zhao, Yan Huang, et al. Safety and efficacy of inetetamab in combination with pyrotinib in HER2 mutant patients with non-small cell lung cancer (NSCLC): An open-label, phase Ib trial. J Clin Oncol 41, 2023 (suppl 16; abstr 9105)
关于赛普汀®:
赛普汀®(伊尼妥单抗)是中国首个获批上市的创新抗 HER2 单抗,与化疗药物联合,可用于治疗HER2 阳性的转移性乳腺癌患者。作为国家“十二五”生物制药重大专项项目,伊尼妥单抗于 2020 年 6 月获得 NMPA 批准上市,其上市打破了外资药企长达 18 年的抗HER2 单抗垄断地位,有力地推进了中国抗体生物药的自主研发热潮。2020 年 12 月底,伊尼妥单抗通过了医保谈判,首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2020 年版)》。目前,伊尼妥单抗被正式纳入 CSCO 乳腺癌诊疗指南和 CACA-CBCS 指南等国内权威指南,成为晚期乳腺癌全程抗 HER2 治疗的基础药物,在 2023 版CSCO 乳腺癌诊疗指南中被列为 HER2+晚期乳腺癌 H 敏感患者抗 HER2 治疗的 I 级推荐用药。
关于三生国健
三生国健是中国首批专注于创新型抗体药物研究并持续积极创新,拥有研、产、销一体化成熟平台,专注于单抗、双抗、多抗及多功能重组蛋白等新技术研究。公司拥有超过18年大规模抗体产业化和质量控制经验,并多维度布局CDMO业务,巩固和增强创新型治疗药物企业的领导地位。目前,公司拥有13个处于不同开发阶段的在研创新药物,其中大部分在研药物为治疗用生物制品1类,部分在研药物为中美双报。请访问www.3s-guojian.com获取更多信息。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。