2023年美国肿瘤学会(ASCO)年会将于6月2日至6日在美国芝加哥市McCormick会展中心举办。一年一度的ASCO年会汇聚来自全球临床肿瘤学研究的精英,将展示当前国际最前沿的临床肿瘤学科研成果和肿瘤治疗技术。近日,ASCO年会公布了由河南省肿瘤医院闫敏教授发起的伊尼妥单抗联合优替德隆与卡瑞利珠单抗在治疗HER2阳性转移性乳腺癌的临床II期试验研究结果(研究代号:ICU)。


摘要号:1042
研究题目:抗HER2单抗伊尼妥单抗联合卡瑞利珠单抗与优替德隆治疗HER2阳性经治转移性乳腺癌:II期ICU临床试验的最终结果
研究背景:
在各大指南推荐中,HER2阳性晚期乳腺癌一线治疗应以含H为基础的联合治疗,二线治疗应以含T-DM1或TKIs药物作为方案选择之一,但对于曲妥珠单抗和TKIs药物均失败的患者目前仍以含曲妥珠单抗为基础的治疗,但获益有限,急需寻找新的治疗策略。
HER2阳性乳腺癌患者在接受两种或两种以上HER2靶向治疗后的治疗选择很少。本研究旨在研究伊尼妥单抗联合免疫药物等药物对接受曲妥珠单抗和酪氨酸激酶抑制剂(TKIs)至少两种HER2靶向治疗后进展的HER2阳性复发或转移性乳腺癌患者的疗效和安全性。
伊尼妥单抗(商品名:赛普汀®)是由三生国健自主研发的创新抗HER2单抗,已正式获得国家药品监督管理局(NMPA)批准、联合化疗用于治疗HER2阳性的转移性乳腺癌。伊尼妥单抗具有与曲妥珠单抗相同的2个Fab段,各214个氨基酸,但是对Fc段进行了氨基酸修饰,是中国自主研发并上市的首个创新抗HER2单抗。
同时,免疫治疗是肿瘤治疗的研究热点。目前PD-1/PD-L1抑制剂对三阴性乳腺癌的治疗已经得到认可,虽然对于HER2阳性乳腺癌的报道相对较少,但分子机制及临床试验的研究结果已证实PD-1/PD-L1抑制剂治疗HER2阳性乳腺癌有良好的临床疗效。抗HER2分子靶向药物具有发挥作用快、安全性高的特点,而PD-1/PD-L1抑制剂有起效慢、效果持久的特点,所以两者结合有望更好地发挥抗肿瘤作用。
研究方法:
该研究是一项单臂、开放、多中心、探索性研究,既往至少接受过曲妥珠单抗和TKI治疗失败且不超过4线的HER2阳性乳腺癌患者,接受伊尼妥单抗(赛普汀®)+卡瑞利珠单抗联合优替德隆治疗,研究主要终点为3个月PFS率。
本研究按照Simon优化两阶段设计,第一阶段入组10例受试者,若仅有5例或更少的受试者在3个月时无进展生存,则因疗效证据不足提前终止试验;若有6例或更多的受试者在3个月时无进展生存,则进入第二阶段,继续入组31例,共入组41例受试者。
在这项II期研究中,患者静脉注射伊尼妥单抗(8 mg/kg负荷剂量,然后6 mg/kg维持,第1天)、卡瑞利珠单抗 (200 mg/ 3周1次)、和优替德隆 (30 mg/m2,第1-5天),直到疾病进展或无法耐受的毒性。根据实体瘤疗效评价标准V1.1版,主要终点为3个月无进展生存(PFS)率。次要终点包括客观缓解率(ORR)、PFS、总生存期和安全性。

研究结果:
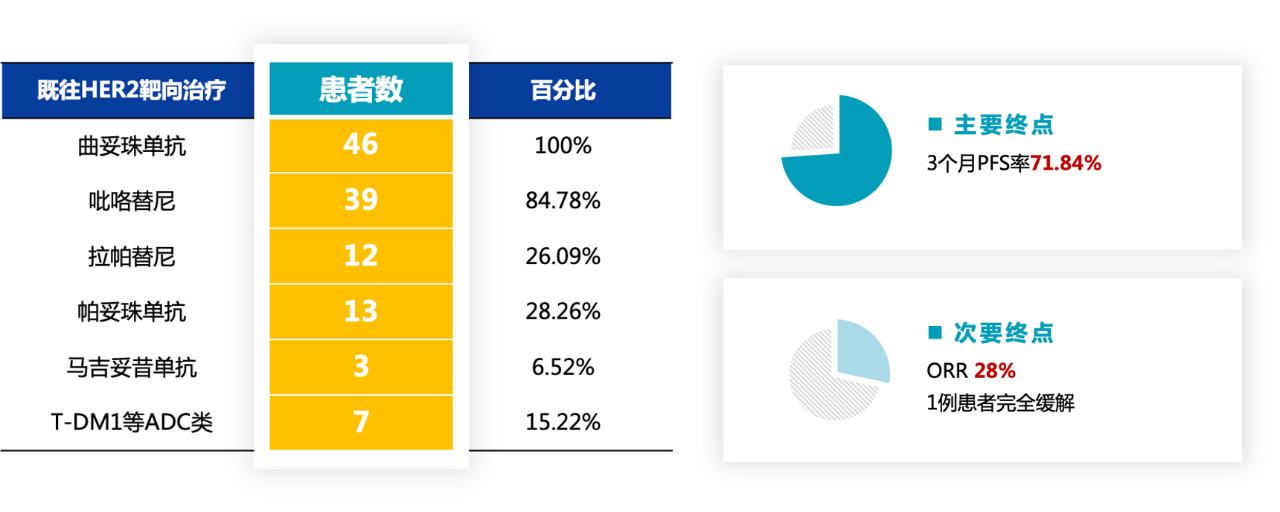
自2021年4月23日至2022年9月1日,该研究共计入组46例患者,既往治疗线数中位值为3线。截至2023年1月18日,中位随访时间为11.37个月,三个月无进展生存(PFS)率为71.84%,中位PFS为5.59个月,ORR(客观缓解率)为28%,DCR(疾病控制率)为84.4%,其中一例患者完全缓解(CR)。安全性方面,无4级及以上治疗相关不良事件(TRAEs)发生,3级周围神经病变和AST升高仅各1例,没有相关治疗中断或死亡发生。
研究结论:
伊尼妥单抗(商品名:赛普汀®)及卡瑞利珠单联合优替德隆在经曲妥珠单抗及TKIs药物治疗失败的HER2阳性晚期乳腺癌患者的治疗中疗效可期,安全性可控,具有良好的风险获益比,为晚期HER2阳性乳腺癌多线经治患者提供新的治疗选择。
本研究摘要将在2023 ASCO以壁报展示的形式呈现。

参考文献:
Huimin Lv, Min Yan, Tao Sun, et al. Anti-HER2 antibody inetetamab plus camrelizumab and utidelone for pretreated HER2-positive metastatic breast cancer: Final results from the phase 2 ICU trial. J Clin Oncol 41, 2023 (suppl 16; abstr 1042)
关于赛普汀®:
赛普汀®(伊尼妥单抗)是中国首个获批上市的创新抗 HER2 单抗,与化疗药物联合,可用于治疗HER2 阳性的转移性乳腺癌患者。作为国家“十二五”生物制药重大专项项目,伊尼妥单抗于 2020 年 6 月获得 NMPA 批准上市,其上市打破了外资药企长达 18 年的抗HER2 单抗垄断地位,有力地推进了中国抗体生物药的自主研发热潮。2020 年 12 月底,伊尼妥单抗通过了医保谈判,首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2020 年版)》。目前,伊尼妥单抗被正式纳入 CSCO 乳腺癌诊疗指南和 CACA-CBCS 指南等国内权威指南,成为晚期乳腺癌全程抗 HER2 治疗的基础药物,在 2023 版CSCO 乳腺癌诊疗指南中被列为 HER2+晚期乳腺癌 H 敏感患者抗 HER2 治疗的 I 级推荐用药。
关于三生国健
三生国健是中国首批专注于创新型抗体药物研究并持续积极创新,拥有研、产、销一体化成熟平台,专注于单抗、双抗、多抗及多功能重组蛋白等新技术研究。公司拥有超过18年大规模抗体产业化和质量控制经验,并多维度布局CDMO业务,巩固和增强创新型治疗药物企业的领导地位。目前,公司拥有13个处于不同开发阶段的在研创新药物,其中大部分在研药物为治疗用生物制品1类,部分在研药物为中美双报。请访问www.3s-guojian.com获取更多信息。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。


摘要号:1042
研究题目:抗HER2单抗伊尼妥单抗联合卡瑞利珠单抗与优替德隆治疗HER2阳性经治转移性乳腺癌:II期ICU临床试验的最终结果
研究背景:
在各大指南推荐中,HER2阳性晚期乳腺癌一线治疗应以含H为基础的联合治疗,二线治疗应以含T-DM1或TKIs药物作为方案选择之一,但对于曲妥珠单抗和TKIs药物均失败的患者目前仍以含曲妥珠单抗为基础的治疗,但获益有限,急需寻找新的治疗策略。
HER2阳性乳腺癌患者在接受两种或两种以上HER2靶向治疗后的治疗选择很少。本研究旨在研究伊尼妥单抗联合免疫药物等药物对接受曲妥珠单抗和酪氨酸激酶抑制剂(TKIs)至少两种HER2靶向治疗后进展的HER2阳性复发或转移性乳腺癌患者的疗效和安全性。
伊尼妥单抗(商品名:赛普汀®)是由三生国健自主研发的创新抗HER2单抗,已正式获得国家药品监督管理局(NMPA)批准、联合化疗用于治疗HER2阳性的转移性乳腺癌。伊尼妥单抗具有与曲妥珠单抗相同的2个Fab段,各214个氨基酸,但是对Fc段进行了氨基酸修饰,是中国自主研发并上市的首个创新抗HER2单抗。
同时,免疫治疗是肿瘤治疗的研究热点。目前PD-1/PD-L1抑制剂对三阴性乳腺癌的治疗已经得到认可,虽然对于HER2阳性乳腺癌的报道相对较少,但分子机制及临床试验的研究结果已证实PD-1/PD-L1抑制剂治疗HER2阳性乳腺癌有良好的临床疗效。抗HER2分子靶向药物具有发挥作用快、安全性高的特点,而PD-1/PD-L1抑制剂有起效慢、效果持久的特点,所以两者结合有望更好地发挥抗肿瘤作用。
研究方法:
该研究是一项单臂、开放、多中心、探索性研究,既往至少接受过曲妥珠单抗和TKI治疗失败且不超过4线的HER2阳性乳腺癌患者,接受伊尼妥单抗(赛普汀®)+卡瑞利珠单抗联合优替德隆治疗,研究主要终点为3个月PFS率。
本研究按照Simon优化两阶段设计,第一阶段入组10例受试者,若仅有5例或更少的受试者在3个月时无进展生存,则因疗效证据不足提前终止试验;若有6例或更多的受试者在3个月时无进展生存,则进入第二阶段,继续入组31例,共入组41例受试者。
在这项II期研究中,患者静脉注射伊尼妥单抗(8 mg/kg负荷剂量,然后6 mg/kg维持,第1天)、卡瑞利珠单抗 (200 mg/ 3周1次)、和优替德隆 (30 mg/m2,第1-5天),直到疾病进展或无法耐受的毒性。根据实体瘤疗效评价标准V1.1版,主要终点为3个月无进展生存(PFS)率。次要终点包括客观缓解率(ORR)、PFS、总生存期和安全性。

研究设计
研究结果:
自2021年4月23日至2022年9月1日,该研究共计入组46例患者,既往治疗线数中位值为3线。截至2023年1月18日,中位随访时间为11.37个月,三个月无进展生存(PFS)率为71.84%,中位PFS为5.59个月,ORR(客观缓解率)为28%,DCR(疾病控制率)为84.4%,其中一例患者完全缓解(CR)。安全性方面,无4级及以上治疗相关不良事件(TRAEs)发生,3级周围神经病变和AST升高仅各1例,没有相关治疗中断或死亡发生。

研究结论:
伊尼妥单抗(商品名:赛普汀®)及卡瑞利珠单联合优替德隆在经曲妥珠单抗及TKIs药物治疗失败的HER2阳性晚期乳腺癌患者的治疗中疗效可期,安全性可控,具有良好的风险获益比,为晚期HER2阳性乳腺癌多线经治患者提供新的治疗选择。
本研究摘要将在2023 ASCO以壁报展示的形式呈现。
参考文献:
Huimin Lv, Min Yan, Tao Sun, et al. Anti-HER2 antibody inetetamab plus camrelizumab and utidelone for pretreated HER2-positive metastatic breast cancer: Final results from the phase 2 ICU trial. J Clin Oncol 41, 2023 (suppl 16; abstr 1042)
关于赛普汀®:
赛普汀®(伊尼妥单抗)是中国首个获批上市的创新抗 HER2 单抗,与化疗药物联合,可用于治疗HER2 阳性的转移性乳腺癌患者。作为国家“十二五”生物制药重大专项项目,伊尼妥单抗于 2020 年 6 月获得 NMPA 批准上市,其上市打破了外资药企长达 18 年的抗HER2 单抗垄断地位,有力地推进了中国抗体生物药的自主研发热潮。2020 年 12 月底,伊尼妥单抗通过了医保谈判,首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2020 年版)》。目前,伊尼妥单抗被正式纳入 CSCO 乳腺癌诊疗指南和 CACA-CBCS 指南等国内权威指南,成为晚期乳腺癌全程抗 HER2 治疗的基础药物,在 2023 版CSCO 乳腺癌诊疗指南中被列为 HER2+晚期乳腺癌 H 敏感患者抗 HER2 治疗的 I 级推荐用药。
关于三生国健
三生国健是中国首批专注于创新型抗体药物研究并持续积极创新,拥有研、产、销一体化成熟平台,专注于单抗、双抗、多抗及多功能重组蛋白等新技术研究。公司拥有超过18年大规模抗体产业化和质量控制经验,并多维度布局CDMO业务,巩固和增强创新型治疗药物企业的领导地位。目前,公司拥有13个处于不同开发阶段的在研创新药物,其中大部分在研药物为治疗用生物制品1类,部分在研药物为中美双报。请访问www.3s-guojian.com获取更多信息。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。